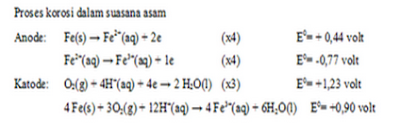Jumat, 26 Oktober 2012
Selasa, 23 Oktober 2012
Korosi Besi
Hari, tanggal : Selasa, 16 Oktober 2012
I.
Tujuan
· Mengamati perubahan atau perkaratan besi
· Mengamati proses oksidasi dan reduksi yang terjadi pada besi
II.
Dasar Teori
Korosi merupakan proses degradasi,
deteorisasi, pengerusakan material yang disebabkan oleh pengaruh lingkungan
sekelilingnya. Adapun prosesnya yakni merupakan reaksi redoks antara suatu
logam dengan berbagai zat disekelilingnya tersebut. Dalam bahasa sehari-hari
korosi disebut dengan perkaratan. Kata korosi berasal dari bahasa latin
“corrodere” yang artinya pengrusakan logam atau perkaratan. Jadi jelas korosi
dikenal sangat merugikan. Korosi meruapakn system termodinamika logam dengan
lingkungannya, yang berusaha untuk mencapai kesetimbangan. System ini dikatakan
setimbang bila logam telah membentuk oksida atau senyawa kimia lain yang lebih
stabil. Pencengahan korosi merupakan salah satu dari banyak jenis logam yang
penggunaannya sangat luas dalam kehidupan sehari-hari. Namun kekurangan dari
besi ini adalah sifatnya yang sangat mudah mengalami korosi. Padahal besi yang
telah mengalami korosi akan kehilangan nilai jual dan fungsi komersialnya. Ini
tentu saja akan merugikan sekaligus membahayakan. Berdasarkan dari asumsi
tersebut percobaan ini difokuskan dalam upaya pencengahan terjadinya peristiwa
korosi ini khususnya pada besi. Selain itu pada percobaan ini akan diketahui
logam-logam apa sajakah yang dapat menghambat terjadinya korosi sesuai dengan
sifat-sifat kimianya.
Besi merupakan logam yang menempati
urutan kedua dari logam logam yang umum terdapat pada kerak bumi. Besi cukup
reaktif, besi bila dibiarkan diudara terbuka untuk beberapa lama mengalami
perubahan warna yang lazim disebut perkaratan besi. Proses perubahan besi
menjadi berkarat merupakan reaksi redoks yang melihat oksigen:
Fe(s) + O2 -----> Fe2O3
Faktor yang berpengaruh terhadap korosi dapat dibedakan menjadi dua, yaitu yang berasal dari bahan itu sendiri dan dari lingkungan. Faktor dari bahan meliputi kemurnian bahan, struktur bahan, bentuk Kristal, unsur-unsur kelumit yang ada dalam bahan, teknik pencampuran bahan dan sebagainya. Faktor dari lingkungan meliputi tingkat pencemaran udara, suhu, kelembaban, keberadaan zat-zat kimia yang bersifat korosif dan sebagainya. Bahan-bahan korosif (yang dapat menyebabkan korosi) terdiri atas asam, basa serta garam , baik dalam bentuk senyawa an organik maupun organik. Penguapan dan pelepasan bahan-bahan korosif ke udara dapat mempercepat proses korosi. Uadara dalam ruangan yang terlalu asam atau basa dapat mempercepat proses korosi peralatan elektronik yang ada dalam ruangan tersebut.
Flour, hidrogen, flourida beserta
persenyawaan-persenyawaannya dikenal sebagai bahan korosif. Dalam industri,
bahan ini umumnya dipakai untuk sintesa bahan- bahan organik. Ammoniak
(NH3) merupakan bahan kimia yang cukup banyak digunakan dalam
kegiatan industry. Pada suhu dan tekanan normal, bahan ini berada dalam bentuk
gas dan sangat mudah terlepas keudara. Ammoniak dalam kegiatan industri
umumnya digunakan untuk sintesa bahan organik, sebagai bahan anti beku didalam
alat pendingin, juga sebagai bahan untuk pembuatan pupuk. Bejana-bejana
penyimpan amoniak harus selalu diperiksa untuk mencegah terjadinya kebocoran
dan pelepasan bahan ini ke udara. Embun pagi saat ini umumnya mengandung aneka
aerosol, debu serta gas-gas asam seperti NOx dan SOx.
dalam batubara terdapat belerang atau sulfur (S) yang apabila dibakar berubah
menjadi oksida belerang.
Masalah utama berkaitan dengan
peningkatan pengunaan batubara adalah dilepaskannya gas-gas polutan seperti
oksida nitrogen(NOx) dan oksida belerang(SOx). walaupun
sebagian besar pusat tenaga listrik batu bara telah menggunakan alat pembersih
endapan (presipitator) untuk membersihkan partikel-partikel kecil dari asap
batubara, namun NOx dan SOx yang merupakan senyawa gas
dengan bebasnya naik melewati cerobong dan terlepas ke udara bebas. Didalam
udara, kedua gas tersebut dapt berubah menjadi asam nitrat (HNO3)
dana asam sulfat(H2SO4).
Oleh sebab itu, udara menjadi
terlalu asam dan bersifat korosif dengan terlarutnya gas-gas asam tersebut
didalam udara. Udara yang asam ini tentu dapat berinteraksi dengan apa saja,
termasuk komponen-komponen renik didalam peralatan elektronik. Jika hala itu
terjadi, maka proses korosi tidak dapat dihindari lagi. Korosi yang menyerang
piranti maupun komponen-komponen elektronika dapat mengakibatkan kerusakan
bahkan kecelakaan. Karena korosi ini maka sifat elektrik komponen-komponen
elektronika dalam computer,televisi, video, kalkulator, jam didital dan
sebagainnya menjadi rusak. Korosi dapat menyebabkan terbentuknya lapisan
non-konduktor pada komponen elektronik.
Oleh sebab itu, dalam lingkungan
dengan tingkat pencemaran tinggi, aneka barang mulai dari komponen elektronika
renik sampai jembatan baja semakin mudah rusak, bhkan hancur karena korosi.
Dalam beberapa kasus hubungan pendek yang terjadi pada peralatn elektronika
dapat menybabkan terjadinya kebakaran yang menimbulkan kerugian bukan hanya
dalam bentuk kehilangan atau kerusakan maateri tetapi juga korban nyawa.
III. Alat dan Bahan
Alat :
·
Gelas piala 250 ml
·
Cawan petri 5 buah
·
Batang pengaduk
·
Penanggas air
·
Paku
Bahan :
·
Larutan NaCl
·
Agar-agar
·
K3(Fe(CN)6)
·
Fenolftalin
·
Larutan HCl
VI.
Cara Kerja
V.
Hasil Pengamatan
a.
Tabel
Pengamatan terhadap paku selama 30 menit
|
No.
|
Perlakuan
|
Jenis Paku
|
||||
|
Paku Beton
|
Paku Payung Kecil
|
Paku Payung Besar
|
Paku Besi
|
Paku Baut
|
||
|
1.
|
Agar-agar (kontrol)
|
-
|
-
|
-
|
-
|
-
|
|
2.
|
Kontrol + PP
|
-
|
-
|
-
|
-
|
-
|
|
3.
|
Kontrol + NaCl
|
-
|
-
|
-
|
-
|
-
|
|
4.
|
Kontrol + NaOH
|
-
|
-
|
-
|
-
|
-
|
|
5.
|
Kontrol + HCl
|
-
|
-
|
-
|
-
|
-
|
b.
Tabel
Pengamatan terhadap paku selama 1 jam
|
No.
|
Perlakuan
|
Jenis Paku
|
||||
|
Paku Beton
|
Paku Payung Kecil
|
Paku Payung Besar
|
Paku Besi
|
Paku Baut
|
||
|
1.
|
Agar-agar (kontrol)
|
-
|
-
|
-
|
-
|
-
|
|
2.
|
Kontrol + PP
|
-
|
-
|
-
|
-
|
-
|
|
3.
|
Kontrol + NaCl
|
-
|
-
|
-
|
-
|
-
|
|
4.
|
Kontrol + NaOH
|
-
|
-
|
-
|
-
|
-
|
|
5.
|
Kontrol + HCl
|
-
|
-
|
-
|
-
|
-
|
c.
Tabel
Pengamatan terhadap paku selama 2 jam
|
No.
|
Perlakuan
|
Jenis Paku
|
||||
|
Paku Beton
|
Paku Payung Kecil
|
Paku Payung Besar
|
Paku Besi
|
Paku Baut
|
||
|
1.
|
Agar-agar (kontrol)
|
-
|
-
|
-
|
-
|
-
|
|
2.
|
Kontrol + PP
|
-
|
-
|
-
|
-
|
-
|
|
3.
|
Kontrol + NaCl
|
-
|
-
|
-
|
-
|
-
|
|
4.
|
Kontrol + NaOH
|
-
|
-
|
-
|
-
|
-
|
|
5.
|
Kontrol + HCl
|
-
|
-
|
-
|
-
|
-
|
d.
Tabel
Pengamatan terhadap paku selama 24 jam
|
No.
|
Perlakuan
|
Jenis Paku
|
||||
|
Paku Beton
|
Paku Payung Kecil
|
Paku Payung Besar
|
Paku Besi
|
Paku Baut
|
||
|
1.
|
Agar-agar (kontrol)
|
-
|
-
|
-
|
+3
|
-
|
|
2.
|
Kontrol + PP
|
-
|
+3
|
-
|
+3
|
-
|
|
3.
|
Kontrol + NaCl
|
-
|
-
|
-
|
+2
|
+1
|
|
4.
|
Kontrol + NaOH
|
-
|
-
|
-
|
-
|
-
|
|
5.
|
Kontrol + HCl
|
-
|
-
|
-
|
+3
|
-
|
Keterangan :
-
=
tidak terjadi korosi
+1 = terjadi sedikit korosi
+2 = terjadi cukup banyak korosi
+3 = terjadi banyak korosi
II.
Pembahasan
Percobaan yang dilakukan kali ini mengenai
proses korosi besi dengan menggunakan berbagai macam jenis paku yang diberikan
berbagai perlakuan dengan tujuan mengamati perubahan atau perkaratan besi serta
mengamati proses oksidasi dan reduksi yang terjadi pada besi. Macam-macam paku
yang digunakan pada percobaan ini antara lain : paku beton,paku paying kecil
paku paying besar, paku besi, dan paku baut. Banyaknya paku yang digunakan dijadikan
sebagai variable terikat pada praktikum ini,karena praktikan akan membandingkan
jenis paku apa yang lebih mampu bertahan dalam gangguannya menerima zat zat
yang akan membuat paku itu untuk berkorosi. Berbagai macam paku tersebut diberikan berbagai perlakuan yaitu
dimasukkan ke dalam agar-agar sebagai kontrol, dimasukkan ke dalam kontrol +
Fenolftalein (PP), kontrol + NaCl, kontrol + NaOH, dan kontrol + HCl dengan
waktu pengamatan selama 30 menit, 1jam, 2 jam, dan 24 jam.
Awalnya paku dibersihkan dan aquadest 210 ml
dipanaskan menggunakan gelas piala 250 ml diatas penanggas air sampai mendidih.
Lalu ditambahkan satu bungkus agar-agar putih ke dalam aquadest yang telah
mendidih sambil diaduk hingga larut. Hal ini dikarenakan supaya agar-agar tidak
mengeras dan terlanjur menggumpal dalam gelas piala. Agar-agar yang digunakan
pada percobaan ini berfungsi sebagai medium indikator dan digunakan untuk
mengetahui tempat-tempat reaksi anoda dan katoda terjadi.
Setelah mendidih agar-agar tersebut dituangkan sebanyak
35 ml kedalam cawan petri yang telah diisi paku dengan bermacam-macam jenis pada
masing-masing cawan petri sampai seluruh permukaan paku agar paku tidak
terkena udara sehingga akan mempengaruhi korosi.
. Kemudian cawan 1 dijadikan sebagai kontrol,
cawan 2 ditambahkan dengan 3,6 ml Fenolftalein (PP) yang menyebabkan
adanya warna merah muda dengan adanya OH-, warna merah muda dalam
gel menunjukkan tempat dimana reduksi, cawan 3 ditambahkan dengan 3,6 ml NaCl, cawan 4 ditambahkan
dengan 3,6ml NaOH, dan cawan 5 ditambahkan dengan HCl.
Berdasarkan hasil pengamatan, dalam
waktu 30 menit, 1 jam, dan 2 jam belum terjadi korosi pada tiap-tiap paku di 5
cawan tersebut. Tetapi dalam waktu 24 jam mulai terlihat adanya korosi pada
paku. Pada cawan 1 yang dijadikan kontrol, terjadi banyak korosi pada paku
besi. Pada cawan 2 yang ditambahkan PP, terjadi banyak korosi pada paku payung
kecil dan paku besi. Pada cawan 3 yang ditambahkan NaCl, terjadi cukup banyak
korosi pada paku besi dan terjadi sedikit korosi pada paku baut. NaCl merupakan
larutan elektrolit. Kontak dengan elektrolit dapat mempercepat korosi karena
elektrolit memberikan pengaruh, seperti jembatan garam sehingga mobilitas
elektron akan makin tinggi dan korosi akan berjalan lebih cepat. Pengaratan yang terbentuk disekitar paku berwarna kuning muda, warna
kuning muda ini menandakan bahwa besi yang terkandung dalam paku dioksidasi
menjadi Fe3+, dalam larutan, ion Fe3+ berwarna kuning muda. Pada cawan 4 yang ditambahkan NaOH, tidak terjadi korsi pada
jenis paku apapun. Hal ini karena energi potensial
yang diberikan basa lebih kecil dari asam ,maka pengkaratan dalam suasana basa
akan lebih lambat terjadi.
Dan pada cawan 5 yang ditambahkan HCl, terjadi banyak korosi
pada paku besi. Hal ini karena potensial korosi dalam suasana
asam lebih besar dari suasana basa sehingga reaksi korosi akan lebih cepat
berlangsung dalam lingkungan asam. Selain itu, pada reaksi suasana asam
diperoleh hasil karat besi dan ion H+ yang mempercepat korosi
selanjutnya. Larutan yang bersifat basa juga
dapat mengakibatkan korosi tetapi prosesnya lebih lambat.
Faktor-faktor yang mempengaruhi terjadinya
korosi diantaranya : tingkat keasaman, kontak dengan elektrolit, keadaan logam
besi itu sendiri, keaktifan logam, dan kontak dengan logam lain.
Pada peristiwa korosi, logam mengalami oksidasi, sedangkan
oksigen (udara) mengalami reduksi. Rumus kimia karat besi adalah Fe2O3. xH2O,
suatu zat padat yang berwarna coklat-merah. Korosi merupakan proses
elektrokimia. Pada korosi besi, bagian tertentu dari besi itu berlaku sebagai
anode, di mana besi mengalami oksidasi. Elektron yang dibebaskan di anode
mengalir ke bagian lain besi itu yang bertindak sebagai katode, di mana oksigen
tereduksi.
Ion besi (II) yang terbentuk pada anode selanjutnya teroksidasi membentuk ion besi(III) yang kemudian membentuk senyawa oksida terhidrasi, Fe2O3. xH2O, yaitu karat besi. Mengenai bagian mana dari besi itu yang bertindak sebagai anode dan bagian mana yang bertindak sebagai katode, bergantung pada berbagai faktor, misalnya zat pengotor, atau perbedaan rapatan logam itu.
Ion besi (II) yang terbentuk pada anode selanjutnya teroksidasi membentuk ion besi(III) yang kemudian membentuk senyawa oksida terhidrasi, Fe2O3. xH2O, yaitu karat besi. Mengenai bagian mana dari besi itu yang bertindak sebagai anode dan bagian mana yang bertindak sebagai katode, bergantung pada berbagai faktor, misalnya zat pengotor, atau perbedaan rapatan logam itu.
Proses korosi pada besi dalam suasana asam:
Proses
korosi besi dalam suasana basa :
Harga potensial reduksi dalam suasana asam lebih besar
sehingga proses korosi lebih cepat.
Larutan garam (dalam percobaan ini adalah NaCl) juga dapat mengakibatkan terjadinya korosi. Hal ini disebabkan karena garam NaCl, Na+ + Cl- merupakan garam dari hasil asam kuat dan basa kuat. Cl- membuat sifatnya yang korosif, menimbukan perkaratan pada paku. Cawan yang diisi dengan indikator fenolftalein (PP) juga mengalami proses korosi dan menimbulkan warna keunguan di beberapa paku, warna tersebut menunjukkan tempat terjadinya reaksi reduksi.
Larutan garam (dalam percobaan ini adalah NaCl) juga dapat mengakibatkan terjadinya korosi. Hal ini disebabkan karena garam NaCl, Na+ + Cl- merupakan garam dari hasil asam kuat dan basa kuat. Cl- membuat sifatnya yang korosif, menimbukan perkaratan pada paku. Cawan yang diisi dengan indikator fenolftalein (PP) juga mengalami proses korosi dan menimbulkan warna keunguan di beberapa paku, warna tersebut menunjukkan tempat terjadinya reaksi reduksi.
VII.
Kesimpulan
·
Proses korosi terjadi ketika apabila
ada oksigen dari sistem maupun lingkungan dan air.
·
Harga potensial reduksi yang lebih
besar mengakibatkan proses korosi lebih cepat.
·
Faktor-faktor yang
mempengaruhi terjadinya korosi diantaranya : tingkat keasaman, kontak
dengan elektrolit, keadaan logam besi itu sendiri, keaktifan logam,
dan kontak dengan logam lain.
·
Keasaman
tinggi merupakan faktor utama meningkatkan laju korosi.
·
NaCl berfungsi sebagai
jembatan garam.
VIII.
Daftar Pustaka
·
Chalid,Sri Yadial. 2007.
Penuntun Praktikum Kimia Anorganik. Jakarta : Fakultas Sains dan
Teknologi UIN Syarif Hidayatullah
·
Svehla, G., 1990, Buku Teks Analisis
Anorganik Kualitatif Makro dan Semimikro. Jakarta : PT. Kalman Media Pustaka .
·
Trethewey, K. R.,
dan Camberlain, J., 1991, Korosi. Jakarta : PT. Gramedia
Pustaka Utama.
·
http://rialylakubl.blogspot.com/2010/12/laporan-korosi.html
diakses pada 20 Oktober 2012 pukul
17.55 WIB
·
http://iefha-shun.blogspot.com/2009/10/laporan-korosi_23.html diakses pada 20
Oktober 2012 pukul 18.00 WIB
Lampiran
Pertanyaan
1. Apa tanda-tanda
telah terjadi proses redoks pada percobaan ini ?
2. Tuliskan reaksi redoks
yang terjadi !
3. Sebutkan reagen-reagen
apa saja yang dapat meleburkan logam Fe ?
4. Senyawa apa saja yang
terdapat pada besi komersial ?
Jawaban
1. Besi berubah menjadi besi (III) oksida yaitu
merupakan karat besi.
2. Fe(s) → Fe2+(aq) + 2e (x2)
O2(g) + 4H+(aq) + 4e → 2H2O(l)
|
|
4 Fe2+(aq)+ O2 (g) + (4 + 2x) H2O(l) → 2 Fe2O3x
H2O + 8 H+(aq)
3. Reagen yang dapat meleburkan logam Fe adalah K3Fe(CN)6,
HCl dan NaCl
4. Besi komersial merupakan campuran besi dan
karbon. tambahan unsur Karbon (C) sampai dengan 1.67% (maksimal). Dimana
kandungan karbon (C) mempengaruhi kekerasan baja, Disamping itu, baja
mengandung unsure campuran lain yang disebut paduan, misalnya Mangan (Mn),
Tembaga (Cu), Silikon (Si), Belerang (S), dan Posfor (P).
Langganan:
Komentar (Atom)